在这个人人追求“瘦”美的时代,屏幕前的你或许也因为减肥而苦恼,总是用着吃饱了才能减肥的借口而失败,因此减肥药成功抓住了像你一样减肥人士的心理。
当数百万人在社交媒体上分享着使用‘减肥神药’后身材的惊人变化时,很少有人会想到,这些神奇的分子在完成它们的人体使命后,会开启另一段漫长的旅程——一段最终汇入我们江河湖海的‘生态冒险’。
以当今市面上最广泛流行的减肥药——司美格鲁肽为例,其凭借“打一针瘦十斤”的夸张效果迅速“出圈”,更有顶级富豪马斯克为其大力宣传,其自然而然也成为了现如今全球销量最高的减肥处方药(虽然替尔泊肽也以极大的增长速率追赶,但是两者都是GPA-1类药物,效果是一致的)
翻译:禁食+诺和泰/维戈维+我附近没有美味的食物
减重版 Wegovy 销售额为 368.88 亿丹麦克朗(54.41 亿美元) ,同比增长 78%,中国区销售额为 8.42 亿丹麦克朗(1.24 亿美元)。[1]
那到底什么是司美格鲁肽?
司美格鲁肽是一种用于治疗Ⅱ型糖尿病和肥胖的药物,它属于一类叫作胰高血糖素样肽-1(GLP-1)受体激动剂的药物。GLP-1是一种自然存在于人体的激素,它可以在餐后刺激胰岛素的分泌,抑制胰高血糖素的分泌,延缓胃的排空,减少食欲,从而降低血糖和体重。[2]
简单而言就是让你充满饱腹感而不再想进食,因此也就得到了减肥的效果。
然而,就像一枚硬币的两面,正是这种稳定且强大的分子特性,让它不仅在人体内持久作用,也能在自然环境中”顽固”存留,开启了下一段旅程。
司美格鲁肽的旅程
下面这张图,清晰地展示了它从药瓶到鱼体的完整路径:
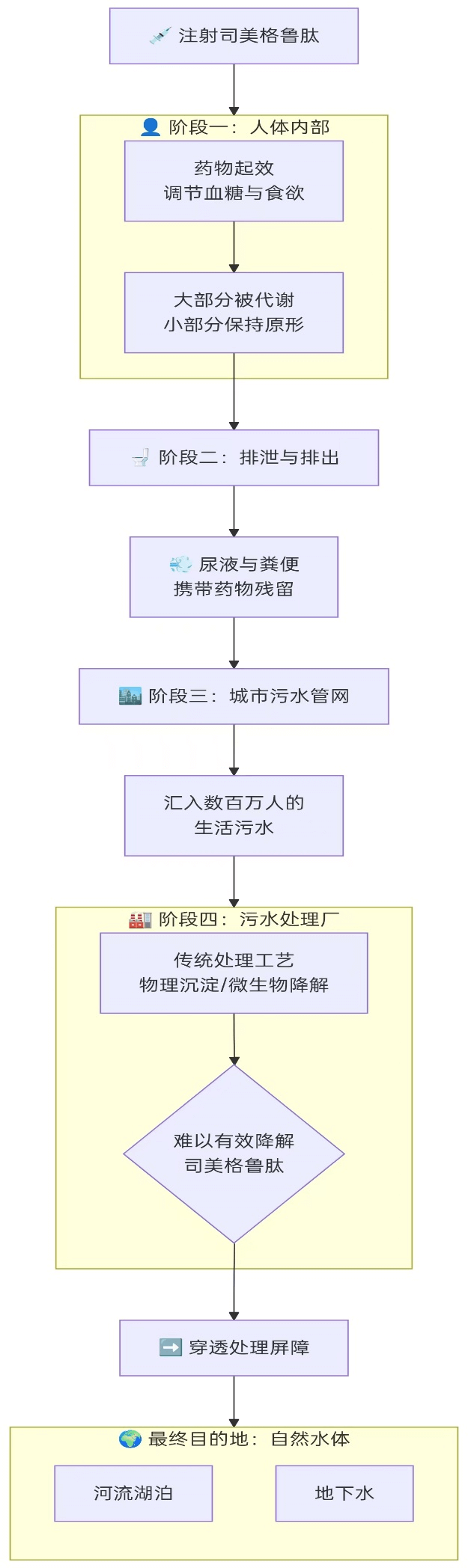
看,我们的一次排泄,就是它生态冒险的起点。
为何减肥药最终会变为环境的“毒素”
虽然仅仅只有微量的司美格鲁肽进入自然水体,但我们仍需要提起足够的重视,这就像在一个奥林匹克标准泳池里滴入一滴墨水,虽然肉眼看不见,但对敏感的鱼来说,却足以扰乱它们的整个生理系统。
尽管关于司美格鲁肽的直接生态毒性研究尚在积累,但大量同类药物的研究已为我们拉响了警报。下表揭示的,正是这些微量药物可能带来的巨大伤害:
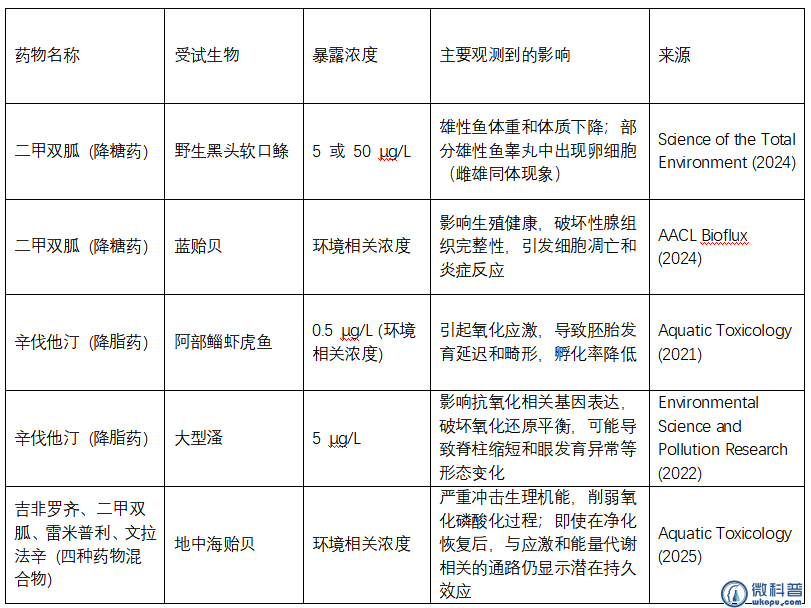
作为同样稳定且具有生物活性的GLP-1类药物,司美格鲁肽极有可能遵循相似的危害路径。它可能干扰鱼类性激素平衡,导致种群衰退;也可能破坏水生生物的能量代谢,让它们变得虚弱不堪。
总的来说,虽然关于司美格鲁肽对水生生物影响的具体研究还在不断深入,但同类药物的研究已经为我们敲响了警钟。这些药物,即便在很低浓度下,也可能对水生生物造成内分泌干扰、生殖异常、氧化应激等多方面的负面影响。
飞速的科技而被忽视的“慢代价”
这揭示了一个深刻的现代悖论:我们以‘互联网速度’研发和推广新科技,追求即时的健康与美丽,但自然环境的反馈却是一部缓慢的”纪录片”。我们享受”快科技”的红利,却将”慢环境”的成本悄然”外包”给了未来与整个生态系统。
这不是要指责任何一位寻求健康之人的个体选择,而是指向一个系统性问题:个人的最优解,如何不成为集体的灾难? 这需要超越个人的共同努力:
1. 对个人而言:意识到每一片药的环境足迹,在必要时使用,并优先选择健康生活方式。
2. 对产业而言:制药行业需承担‘绿色设计’的责任,从源头研发更易降解的药物。
3. 对治理而言:升级污水处理标准,将新型污染物纳入监管,填补‘快科技’留下的环境管理真空。
当我们为身体的代谢找到一把‘钥匙’,也必须为它可能打开的生态之门,准备好另一把责任的‘钥匙’。
下一次,当你考虑使用这类药物时,除了权衡其健康利弊,或许也可以思考一下它隐藏的生态成本。科技的进步,不应以环境的退步为代价。
读完这篇文章,你认为个人、药企和社会,谁该为这场”代谢与生态”的冲突承担更大责任?欢迎在评论区留下你的思考。
参考文献:
1. Novo Nordisk. (2025). Novo Nordisk reports strong H1 2025 growth but lowers full-year outlook. TipRanks.
Retrieved from https://www.tipranks.com/news/company-announcements/novo-nordisk-reports-strong-h1-2025-growth-but-lowers-full-year-outlook
2. 佚名. (n.d.). 司美格鲁肽的作用机制. 大众健康报.
Retrieved from http://paper.dzjkb.org.cn/article/27511/17580.html
3. Ussery, E., McMaster, M., Palace, V., Parrott, J., Blandford, N. C., Frank, R., Kidd, K., Birceanu, O., Wilson, J., Alaee, M., Cunningham, J., Wynia, A., Clark, T., Campbell, S., Timlick, L., Michaleski, S., Marshall, S., ... Nielsen, K. (2024). Effects of metformin on wild fathead minnows (Pimephales promelas) using in-lake mesocosms in a boreal lake ecosystem. Science of the Total Environment, 929, 172457. https://doi.org/10.1016/j.scitotenv.2024.172457
4. Koagouw, W., Hazell, R. J., Ranty, L., & Ciocan, C. (2024). Metformin exposure induces gonadal alterations in mussels Mytilus edulis. AACL Bioflux, 17(6), 2456–2469. http://www.bioflux.com.ro/aacl
5. Xu, H., Li, A., Wang, Q., He, J., Xi, D., Zhang, X., Luo, Z., & Mai, B. (2021). Simvastatin affects the PPARα signaling pathway and causes oxidative stress and embryonic development interference in Mugilogobius abei. Aquatic Toxicology, 239,105951. https://doi.org/10.1016/j.aquatox.2021.105951
6. iu, S., Lin, J., Ding, R., & Nie, X. (2022). Simvastatin as an emerging pollutant on non-target aquatic invertebrates: effects on antioxidant-related genes in Daphnia magna. Environmental Science and Pollution Research, 29(38), 58137–58147. https://doi.org/10.1007/s11356-022-19466-7
7. Bernardini, I., Mezzelani, M., Panni, M., Dalla Rovere, G., Nardi, A., El Idrissi, O., Peruzza, L., Gorbi, S., Ferraresso, S., Bargelloni, L., Patarnello, T., Regoli, F., & Milan, M. (2025). Transcriptional modulation in Mediterranean Mussel Mytilus galloprovincialis following exposure to four pharmaceuticals widely distributed in coastal areas. Aquatic Toxicology, 279, 107255.
https://doi.org/10.1016/j.aquatox.2025.107255
本文作者:厦门大学环境与生态学院朱文韬、李世豪、赖春煜。
本文由海洋负排放(ONCE)国际大科学计划、厦门大学碳中和创新研究中心支持。
责编:微科普